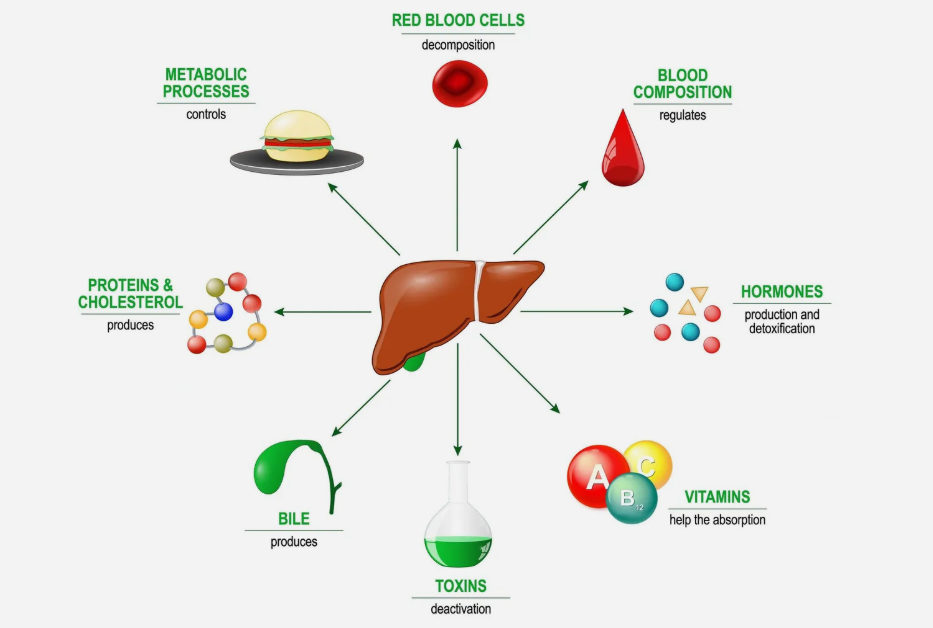
图1. 肝脏几乎参与了机体所有关键的生理过程
(https://fattyliver.ca/blog/f/what-does-the-liver-do)
虽然小鼠是最常用的实验动物,但其肝脏与人类在结构和功能上仍存在显著差异。
首先,小鼠与人类的药物代谢酶系统(如CYP450家族)表达谱不同,导致相同药物在两者体内的代谢产物和毒性表现差异较大(Martignoni M, Groothuis G M M, de Kanter R. Expert opinion on drug metabolism & toxicology, 2006)。
其次,病毒感染机制也存在种属特异性——人类肝炎病毒如HBV和HCV难以在普通小鼠体内感染和复制,限制了肝炎机制研究和抗病毒药物评估(issig K D, Wieland S F, Tran P, et al. The Journal of clinical investigation, 2010)。
此外,小鼠肝细胞对胆汁酸、脂质的调控机制也与人类存在偏差,影响脂肪肝和胆汁淤积等疾病模型的临床相关性(Chiang J Y L. Comprehensive physiology, 2013)。
因此,构建一种“长着人类肝脏”的小鼠——即肝脏人源化小鼠模型,成为解决这些问题的重要手段。这类模型能够更真实地重现人类肝脏生理和病理过程,为新药开发和肝病机制研究打开了全新窗口。
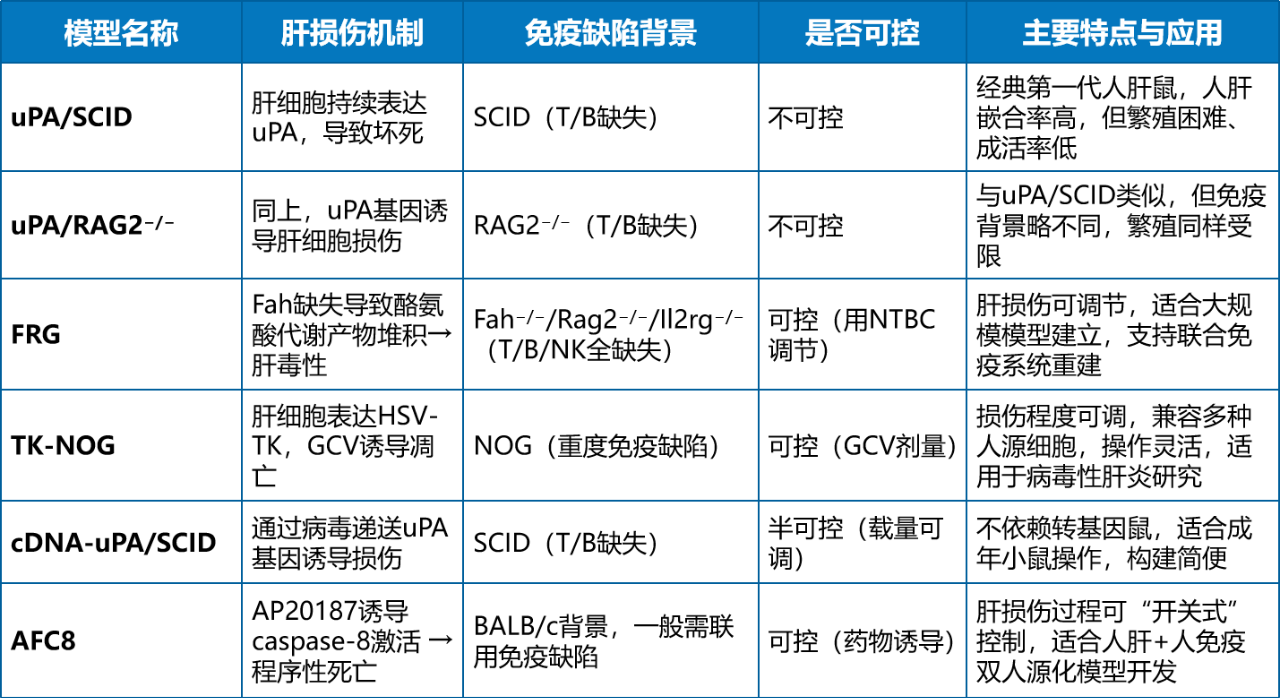
为了在小鼠体内重建功能性的人源肝脏,科学家构建了多种肝脏人源化模型,这一技术也经历了从早期探索到日益完善的发展过程。最早的一代模型以uPA/SCID或uPA/RAG2−/−为代表,通过在小鼠肝脏中过表达uPA基因,诱导严重的肝细胞损伤,为人肝细胞移植腾出“位置”。这些模型虽然可实现高比例人肝嵌合,但因出生率低、生存时间有限,实验难度较高。
随后出现的FRG小鼠(Fah−/−/Rag2−/−/Il2rg−/−)显著提升了模型稳定性。Fah缺失引发的肝损伤可通过药物(NTBC)精确调控,免疫系统三缺陷也为人肝细胞扩增创造了理想环境。另一类如TK-NOG或cDNA-uPA/SCID模型则采用了药物或病毒载体诱导肝损伤的方式,使得人源化过程更加灵活高效。AFC8模型则是在小鼠肝细胞中表达一种融合蛋白(含caspase-8活性),可通过外源性小分子AP20187诱导二聚化,从而精确控制肝细胞凋亡(Luo Y, Lu H, Peng D, et al. Journal of cellular physiology, 2022.// Tateno C, Kojima Y. Laboratory Animal Research, 2020.// Washburn M L, Bility M T, Zhang L, et al. Gastroenterology, 2011.)。
表1,用于构建肝脏人源化的几种小鼠模型
然而,这些模型的共同特点是——仅具有人源肝脏,缺乏人源免疫系统。这使得它们在研究肝炎病毒感染、肝癌免疫逃逸或药物的免疫毒性等问题时仍有局限。例如,虽然可以看到HBV在“人肝鼠”中感染复制,但却无法模拟人类真实的免疫应答过程。
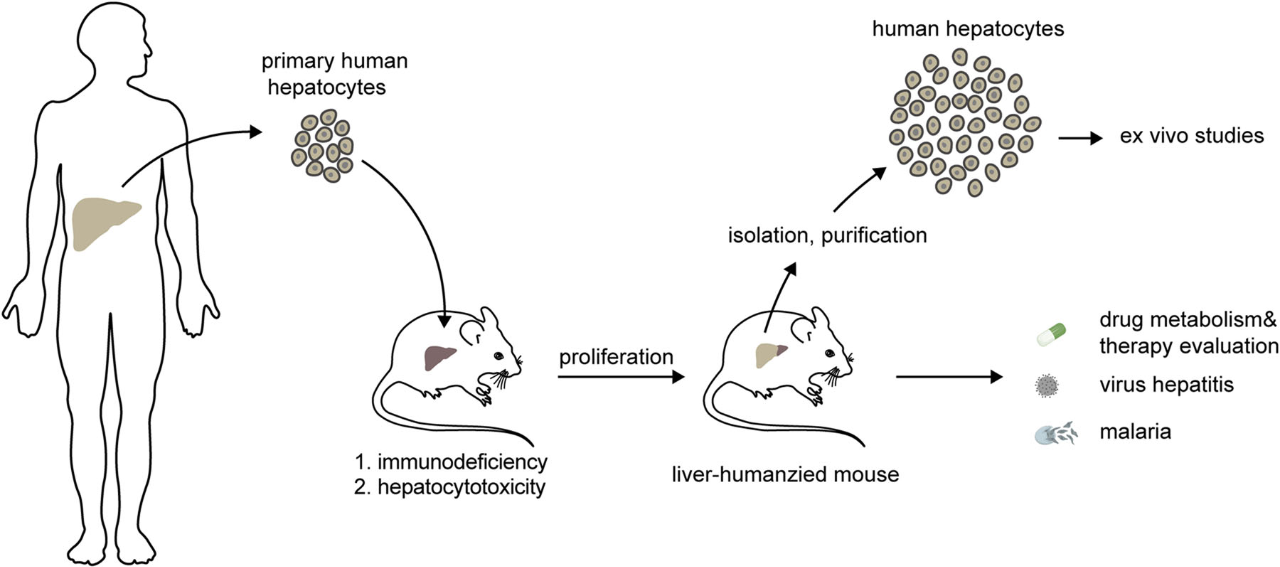
图2. 肝脏人源化小鼠(LHM, liver-humanized mice)构建示意图(Luo Y, Lu H, Peng D, et al. Journal of cellular physiology, 2022.)
为解决这一问题,近年来研究者开始推动“肝脏+免疫系统双人源化”小鼠模型的建立:先通过造血干细胞重建人免疫系统,再联合人源肝细胞移植,让一只小鼠同时拥有“人肝+人免疫系统”。这一创新不仅为病毒性肝炎、免疫相关肝病提供了更贴近临床的模型平台,也为肝癌免疫治疗等领域带来了新的研究工具。
2025年6月27-28日,“2025美国华人生物医药科技协会CBA-China中国年会”在苏州国际博览中心隆重召开。在本次大会上,基锘威生物(genOway)全球首席技术官 Dr. Yacine CHERIFI 为大家带来了肝脏&免疫系统双人源化小鼠模型的最新研究进展。


肝脏&免疫系统双人源化小鼠模型是基于BRGSF进行构建的。BRGSF是一种高度免疫缺陷小鼠模型,主要特征为缺失成熟的鼠源T、B、NK淋巴细胞,髓系细胞发育严重受阻。将人脐带血分离的CD34+ 造血干细胞(HSC)移植至BRGSF小鼠体内,再经Flt3L刺激,这些HSC可分化发育为人源淋巴系和髓系细胞,以这种方式构建的免疫系统人源化小鼠模型被称为BRGSF-HIS(Human Immune System)。
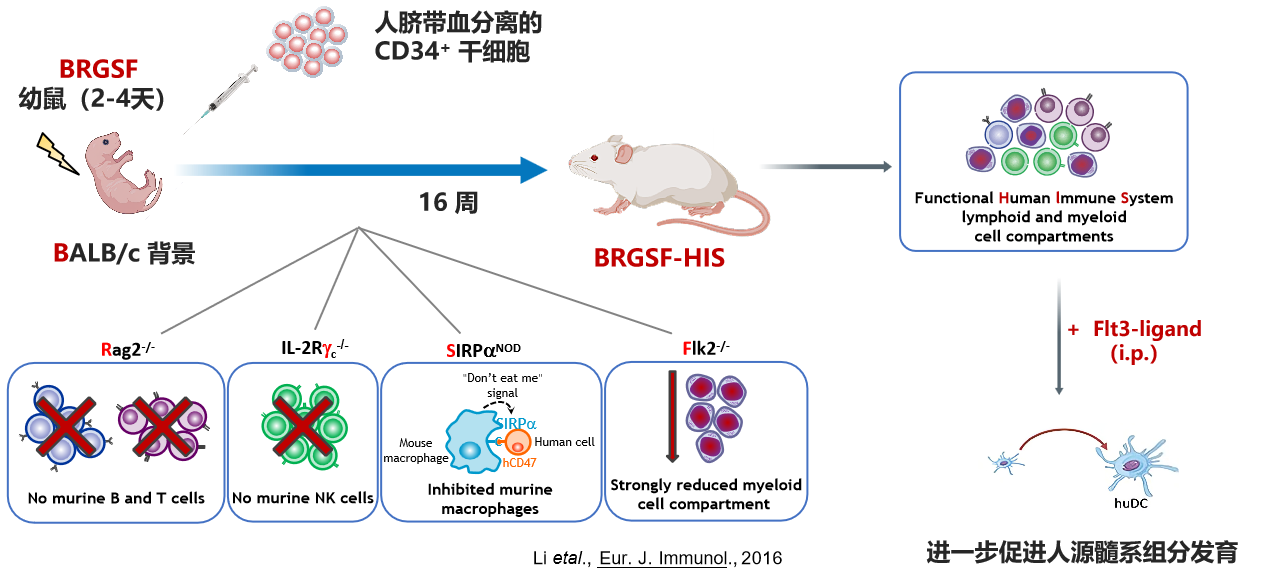
图4. 在BRGSF小鼠上进行免疫系统人源化重建流程
在该BRGSF-HIS模型的基础上,我们进一步将鼠源肝脏细胞诱导凋亡以及人源肝脏细胞/组织定植重建,进而构建了一种全新升级的肝脏&免疫系统双人源化小鼠模型。
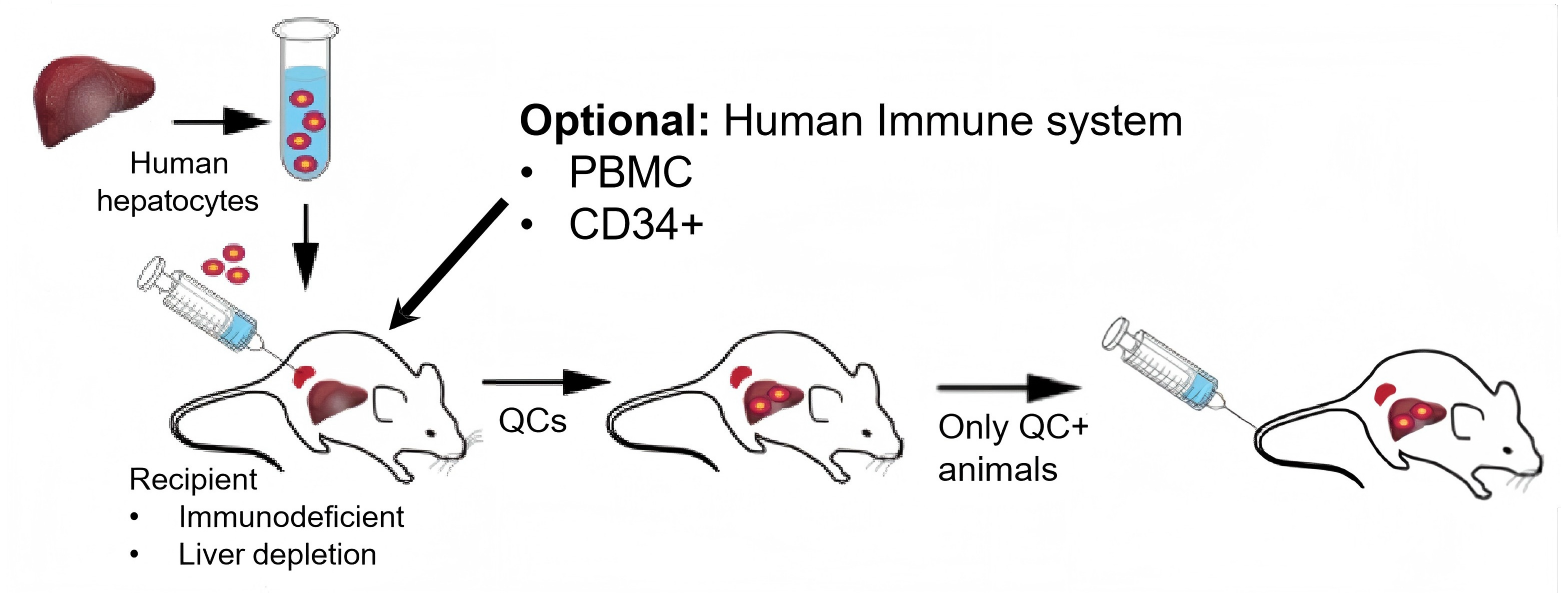
图5. 免疫系统&肝脏双人源化小鼠构建流程
相比传统只具有人源肝脏的模型,肝脏&免疫系统双人源化小鼠在功能还原度上实现了关键跃升。它不仅能够模拟人类肝细胞的代谢功能,还能重建较完整的人源免疫应答系统,让小鼠更接近“类人”状态。正因如此,这一模型为多个前沿研究领域打开了创新的大门:
病毒性肝炎研究
双人源化模型可同时支持HBV、HCV等病毒在人体肝细胞中的复制,并呈现人类免疫系统的应答过程,是研究病毒感染机制、免疫清除与慢性炎症发展的理想工具。
免疫介导的肝毒性评估
在药物研发中,该模型可用于识别因免疫激活引发的人类肝细胞损伤,预测药物相关免疫性肝毒性,提升安全性筛选的临床相关性。
肝癌免疫治疗研究
通过联合移植人源肿瘤细胞与免疫系统,模拟人类肝癌微环境,可用于评估免疫检查点抑制剂、双抗、CAR-T等疗法的体内效果及人肝毒副作用。
作为下一代人源化模型的重要代表,双人源化正逐步成为病毒学、免疫学和肿瘤学等领域的关键研究利器。基锘威生物(genOway)期待与更多合作伙伴携手探索该模型在不同应用场景下的潜力,共同推动其在临床前研究中的价值最大化。
如您有相关研究需求,欢迎随时与我们联系。
参考资料:
https://fattyliver.ca/blog/f/what-does-the-liver-do
Martignoni M, Groothuis G M M, de Kanter R. Species differences between mouse, rat, dog, monkey and human CYP-mediated drug metabolism, inhibition and induction[J]. Expert opinion on drug metabolism & toxicology, 2006, 2(6): 875-894.
issig K D, Wieland S F, Tran P, et al. Human liver chimeric mice provide a model for hepatitis B and C virus infection and treatment[J]. The Journal of clinical investigation, 2010, 120(3): 924-930.
Chiang J Y L. Bile acid metabolism and signaling[J]. Comprehensive physiology, 2013, 3(3): 1191.
Luo Y, Lu H, Peng D, et al. Liver‐humanized mice: A translational strategy to study metabolic disorders[J]. Journal of cellular physiology, 2022, 237(1): 489-506.
Tateno C, Kojima Y. Characterization and applications of chimeric mice with humanized livers for preclinical drug development[J]. Laboratory Animal Research, 2020, 36(1): 2.
Washburn M L, Bility M T, Zhang L, et al. A humanized mouse model to study hepatitis C virus infection, immune response, and liver disease[J]. Gastroenterology, 2011, 140(4): 1334-1344.
关于基锘威生物
genOway,全球知名的动物模型供应商,1999年创立于法国,立足模型原研,并拥有全球独家CRISPR/Cas9基础专利组合(Sigma-Aldrich (Merck)、Berkeley、Broad)许可证,在转基因小鼠、大鼠及细胞模型的研发上取得了显著成果,目前已与全球TOP20药企中的17家、500多家工业及学术机构建立合作。
2023年在中国成立中法合资公司——上海基锘威生物科技有限公司,标志着其全球化战略的重要布局。上海基锘威已建立完善的本地化生产设施,并同步建设继欧美之外的又一大全球化研发平台。这一举措可保障客户获得高品质动物模型的同时降低研发成本,同时大幅缩短中国及其他亚太地区的供货周期,确保客户及时获得所需模型及应用方案,共同推动医药科研领域的创新与发展。
更多信息可进官网查询:www.genoway-sh.com
